Ученые ЛНФ ОИЯИ вместе с коллегами исследовали структурные свойства клеточных мембран и происходящие в них взаимодействия, которые играют важную роль в процессе развития таких разрушительных заболеваний как болезнь Альцгеймера.
Болезнь Альцгеймера – угроза человечеству
Болезнь Альцгеймера, одна из самых затратных по уходу за пациентами, занимает шестое место среди смертельных заболеваний и поражает в основном пожилых людей. Разрушительные изменения в мозге вызывают постепенную потерю памяти и способности ориентироваться в обстановке и в результате приводят к слабоумию. Сегодня ей страдают десятки миллионов людей, и, по оценкам, их количество превысит сто тридцать миллионов к 2050 году. Болезнь, которую называют бичом 21 века развитых стран, получила свое название и описание чуть более века назад в честь немецкого психиатра, впервые исследовавшего симптомы и течение заболевания. Но за это время ученым не удалось до конца разобраться с причинами возникновения болезни, с особенностями протекания и лечения, не появилось и чудодейственного лекарства. К ключевым признакам болезни Альцгеймера относится образование нерастворимых бляшек, в основном амилоидных (бета-амилоидных пептидов, Aβ-пептидов), и нейрофибриллярных клубков в тканях мозга, которое запускает нейродегенеративные изменения, ведущие к гибели нейронов. Среди основных причин происхождения болезни называют амилоидную гипотезу, которая была выдвинута тридцать лет назад. За ее развитие и «за новаторские исследования генетической и молекулярной основы болезни Альцгеймера с далеко идущими перспективами для развития новых терапевтических вмешательств, а также для понимания других нейродегенеративных заболеваний головного мозга» в 2018 четверо ученых получили престижную премию по нейронаукам «The Brain Prize». (The Brain Prize 2018 was awarded to Bart De Strooper, Michel Goedert, Christian Haass, and John Hardy for 'their groundbreaking research on the genetic and molecular basis of Alzheimer’s disease, with far-reaching implications for the development of new therapeutic interventions as well as for the understanding of other neurodegenerative diseases of the brain.)
Но что запускает накопление бета-амилоида, важную роль в котором могут играть взаимодействия между пептидами и клеточной мембраной, и как предотвратить образование бляшек вне мембраны, пока неизвестно.
Взаимодействия в мембране: Aβ-пептиды, холестерин и мелатонин
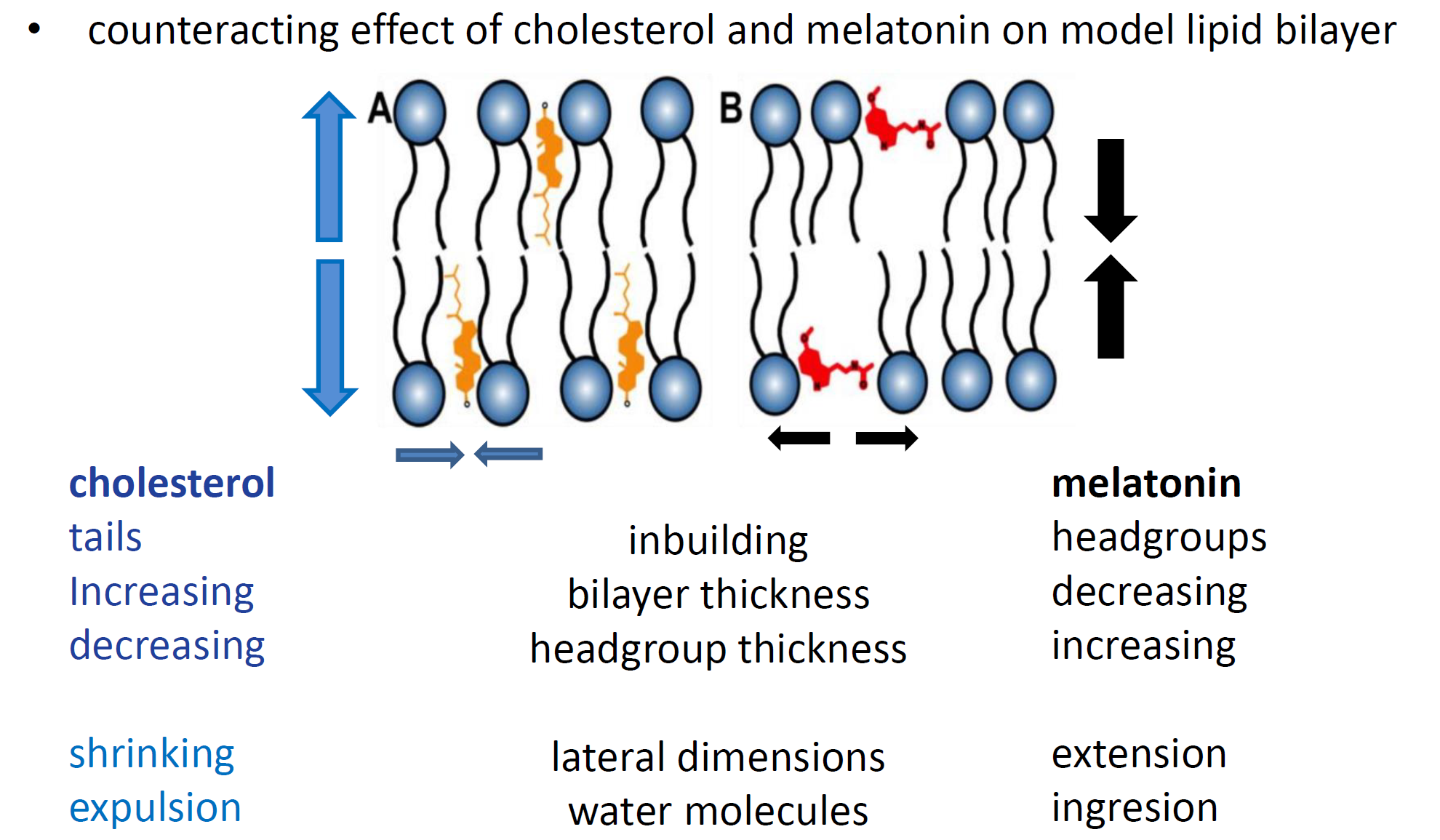
Сложная деятельность нервной ткани связана с биомембранами, структурные и метаболические свойства которых определяют многочисленные липиды, составляющие более половины сухой массы мозга. От их формы, размера и химического состава зависят упругомеханические свойства мембран. Именно эти свойства, состав мембраны и ее толщина определяют проницаемость для частиц среды. Проникая в мембрану, они могут провоцировать и усугублять болезнь или, напротив, предотвращать ее развитие. Например, белки, важные компоненты мембраны, активно переносят вещества сквозь нее. В свою очередь, проницаемость и текучесть мембраны изменяют такие присутствующие в головном мозге вещества, как холестерин и мелатонин, влияние которых активно исследуют ученые. Как известно, уровень мелатонина в организме снижается и уровень холестерина повышается с возрастом. Болезнь Альцгеймера распространяется в более позднем возрасте, поэтому влияние мелатонина и холестерина на липидную мембрану становится все более важным.
Так, холестерин, встраиваясь в мембрану, приводит к увеличению ее не-упругости и упорядоченности, снижая динамические свойства и оказывая влияние на транспортировку различных веществ через мембрану. Если холестерин делает мембрану более жесткой, то мелатонин, напротив, способствует текучести. Таком образом, с помощью этих молекул можно было бы управлять физическими свойствами мембран и, возможно, контролировать процессы образования амилоидных фибрилл и их токсичность. С изменением текучести мембраны связывают многие нарушения функций и различные заболевания, в том числе Альцгеймера, когда по какой-то причине бета-амилоидные пептиды начинают разрушать мембрану нейронов и накапливаться, образуя бляшки. Может быть, обнаружив причину этого, удастся остановить процесс накопления пептидов или удержать их в мембране и не допустить развитие заболевания?
Вооружившись методами малоуглового рассеяния нейтронов, дифракции и рефлектометрии, которые позволяют определить основные параметры мембран, ученые Лаборатории нейтронной физики ОИЯИ в группе исследователей попытались пролить свет на происходящее и проследить за процессами накопления бета-амилоидного пептида в модельных биологических мембранах, включающих холестерин и мелатонин в качестве агентов, влияющих на текучесть мембран.
Нейтроны и мембрана: результаты экспериментов
Подтвердив эффекты «жесткости» и «текучести» мембраны в присутствии холестерина и мелатонина, соответственно, а также утолщение мембраны, нагруженной холестерином, и истончение с мелатонином, исследователи дополнительно изучили изменения, вызванные присутствием пептидов бета-амилоида (Aβ25-35) в модельной мембране на основе липидного бислоя.
На структуру мембран в этом случае влияют изменение температуры, наличие заряда в окружающей среде, увеличение концентрации ионов и их гидратационные свойства.
Как показали методы рассеяния нейтронов, со встраиванием бета-амилоидного пептида связано уменьшение толщины мембраны. При добавлении холестерина, увеличивающего жесткость мембраны, толщина мембраны из-за встраивания пептида тоже уменьшается. В то же время, добавление пептида в мембраны с мелатонином приводит лишь к несущественному изменению толщины мембраны. Это наблюдение привело к предположению об иной в данном случае локализации пептида внутри мембраны.
«Наши эксперименты выявили различия при взаимодействии бета-амилоидного пептида с модельными мембранами, в которых присутствуют холестерин или мелатонин. Визуализация моделирования, выполненного с коллегами из ЛИТ и ЛРБ ОИЯИ с использованием методов молекулярной динамики, показывает, что в случае «жесткой» мембраны с холестерином пептид собирается на границе раздела вода-мембрана, где взаимодействует с полярными липидными головными группами. В «жидкой» же мембране с мелатонином пептид встраивается внутрь гидрофобного ядра мембраны. Полученные результаты указывают на ключевую роль вязкости мембраны при встраивании в нее пептида. Их можно использовать в будущих исследованиях разрушительного воздействия амилоида и в поисках способов блокирования или снижения его воздействия, поскольку они могут дать некоторое представление о молекулярном механизме защитной функции мелатонина при болезни Альцгеймера.», - считает участник исследований Норберт Кучерка, замдиректора по научной работе ЛНФ.
Работа опубликована
Tatiana Murugova, Oleksandr Ivankov, Elena Ermakova, Tomáš Kondela, Pavol Hrubovčák, Vadim Skoi, Alexander Kuklin and Norbert Kučerka. Structural changes introduced by cholesterol and melatonin to the model membranes mimicking preclinical conformational diseases. March 2020. General Physiology and Biophysics. 39(02):135-144. DOI: 10.4149/gpb_2019054
Ольга Баклицкая-Каменева


